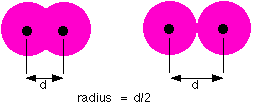Kata Kunci: asam dan basa, basa dan garam, zat kimia, zat-zat kimia
Ditulis oleh Utiya Azizah pada 28-02-2010
Asam, basa dan garam merupakan zat kimia yang memiliki sifat-sifat yang dapat membantu kita untuk membedakannya. Karena pada umumnya asam bersifat masam dan basa berasa agak pahit. Akan tetapi rasa sebaiknya jangan dipergunakan untuk menguji adanya asam atau basa, karena Anda tidak boleh begitu saja mencicipi zat-zat kimia yang belum dikenal karena banyak diantaranya yang bersifat racun atau bersifat korosif.
1. Asam dan Basa dapat Dibedakan dari Rasa dan Sentuhan
Apa yang terdapat dalam pikiran Anda ketika mendengar kata asam? Apakah Anda berpikir pada suatu benda yang rasanya masam atau asam adalah suatu zat yang dapat membakar kulit Anda dan melarutkanlogam? Semua itu tergantung dari sifat khas beberapa asam.Pernahkah Anda membersihkan saluran yang tersumbat dengan pembersih saluran? Meminum obat anti maag (antasid) untuk mengatasi gangguan sakit perut dan merasakan licinnya sabun? Hal ini berarti Anda telah berpengalaman dengan sifat kimia basa.
 Asam mempunyai rasa masam. Rasa masam yang kita kenal misalnya pada beberapa jenis makanan seperti jeruk, jus lemon, tomat, cuka, minuman ringan (soft drink) dan beberapa produk seperti sabun yang mengandung belerang dan air accu (Gambar 13). Sebaliknya, basamempunyai rasa pahit. Tetapi, rasa sebaiknya jangan digunakan untukmenguji adanya asam dan basa, karena beberapa asam dan basa dapat mengakibatkan luka bakar dan merusak jaringan.
Asam mempunyai rasa masam. Rasa masam yang kita kenal misalnya pada beberapa jenis makanan seperti jeruk, jus lemon, tomat, cuka, minuman ringan (soft drink) dan beberapa produk seperti sabun yang mengandung belerang dan air accu (Gambar 13). Sebaliknya, basamempunyai rasa pahit. Tetapi, rasa sebaiknya jangan digunakan untukmenguji adanya asam dan basa, karena beberapa asam dan basa dapat mengakibatkan luka bakar dan merusak jaringan.17
Seperti halnya rasa, sentuhan bukan merupakan cara yang aman untuk menguji basa, meskipun Anda telah terbiasa dengan sentuhan sabun saat mandi atau mencuci. Basa (seperti sabun) bersifat alkali, bereaksi dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami pergantian. Reaksi ini merupakan bagian dari rasa licin yang diberikan oleh sabun, yang sama halnya dengan proses pembersihan dari produk pembersih saluran.
18

Beberapa asam yang telah dikenal dalam kehidupan sehari-hari disajikan dalam Tabel 4.
Tabel 4. Beberapa Asam dan Basa Yang Telah Dikenal
19

Asam juga merupakan kebutuhan industri yang vital. Empat macam asam yang paling penting dalam industri adalah asam sulfat, asam fosfat, asam nitrat dan asam klorida. Asam sulfat (H2SO4) merupakan cairan kental menyerupai oli. Umumnya asam sulfat digunakan dalam pembuatan pupuk, pengilangan minyak, pabrik baja, pabrik plastik, obat-obatan, pewarna, dan untuk pembuatan asam lainnya. Asam fosfat (H3PO4) digunakan untuk pembuatan pupuk dan deterjen. Namun, sangat disayangkan bahwa fosfat dapat menyebabkan masalah pencemaran di danau-danau dan aliran sungai.
Asam nitrat (HNO3) banyak digunakan untuk pembuatan bahan peledak dan pupuk. Asam nitrat pekat merupakan cairan tidak berwarna yang dapat mengakibatkan luka bakar pada kulit manusia. Asam klorida (HCl) adalah gas yang tidak berwarna yang dilarutkan dalam air. Asap HCl dan ion-ionnya yang terbentuk dalam larutan, keduanya berbahaya bagi jaringan tubuh manusia.
Dalam keadaan murni, pada umumnya basa berupa kristal padat. Produk rumah tangga apa yang mengandung basa? Beberapa produk rumah tangga yang mengandung basa, antara lain deodorant, antasid, dan sabun. Basa yang digunakan secara luas adalah kalsium hidroksida, Ca(OH)2 yang umumnya disebut soda kaustik suatu basa yang berupa tepung kristal putih yang mudah larut dalam air. Basa yang paling banyak digunakan adalah amoniak. Amoniak merupakan gas tidak berwarna dengan bau yang sangat menyengat, sehingga sangat mengganggu saluran pernafasan dan paru-paru bila gas terhirup. Amoniak digunakan sebagai pupuk, serta bahan pembuatan rayon, nilon dan asam nitrat.
5 Larutan (KLS XI)

Standar Kompetensi Kompetensi Dasar
1. Memahami konsep larutan elektrolit dan elektrokimia
2. Membedakan larutan elektrolit dan non elektrolit
3. Mengidentifikasi dan mengklasifikasi berbagai larutan
4. Menerapkan konsep reaksi redoks dalam elektrokimia
5. Menggunakan satuan konsentrasi dalam membuat larutan
Tujuan pembelajaran
1. Siswa dapat mengelompokkan larutan ke dalam larutan elektrolit dan non-elektrolit berdasarkan sifat hantaran listrik.
2. Siswa dapat menghitung konsentrasi larutan.
3. Siswa mampu menjelaskan sifat koligatif larutan.
4. Siswa mampu menjelaskan pengaruh zat terlarut terhadap tekanan uap pelarut dan menghitung tekanan uap larutan.
5. Siswa dapat menghitung penurunan titik beku dan tekanan osmosis larutan.
6. Siswa dapat menghubungkan tetapan hasil kali kelarutan (Ksp) dengan tingkat kelarutan atau
pengendapannya berdasarkan percobaan.
5.1 Pendahuluan
Standar Kompetensi Kompetensi Dasar
1. Memahami konsep larutan elektrolit dan elektrokimia
2. Membedakan larutan elektrolit dan non elektrolit
3. Mengidentifikasi dan mengklasifikasi berbagai larutan
4. Menerapkan konsep reaksi redoks dalam elektrokimia
5. Menggunakan satuan konsentrasi dalam membuat larutan
Tujuan pembelajaran
1. Siswa dapat mengelompokkan larutan ke dalam larutan elektrolit dan non-elektrolit berdasarkan sifat hantaran listrik.
2. Siswa dapat menghitung konsentrasi larutan.
3. Siswa mampu menjelaskan sifat koligatif larutan.
4. Siswa mampu menjelaskan pengaruh zat terlarut terhadap tekanan uap pelarut dan menghitung tekanan uap larutan.
5. Siswa dapat menghitung penurunan titik beku dan tekanan osmosis larutan.
6. Siswa dapat menghubungkan tetapan hasil kali kelarutan (Ksp) dengan tingkat kelarutan atau
pengendapannya berdasarkan percobaan.
Gambar 5.1 Proses pelarutan secara umum
Larutan merupakan fase yang setiap hari ada disekitar kita. Suatu sistem homogen yang mengandung dua atau lebih zat yangmasing-masing komponennya tidak bisa dibedakan secara fisik disebut larutan, sedangkan suatu sistem yang heterogen disebut campuran. Biasanya istilah larutan dianggap sebagai cairan yang mengandung zat terlarut, misalnya padatan atau gas dengan kata lain larutan tidak hanya terbatas pada cairan saja. Komponen dari larutan terdiri dari dua jenis, pelarut dan zat terlarut, yang dapat dipertukarkan tergantung jumlahnya. Pelarut
merupakan komponen yang utama yang terdapat dalam jumlah yang banyak, sedangkan komponen minornya merupakan zat terlarut. Larutan terbentuk melalui pencampuran dua atau lebih zat murni
yang molekulnya berinteraksi langsung dalam keadaan tercampur. Semua gas bersifat dapat bercampur dengan sesamanya, karena itu campuran gas adalah larutan. Proses pelarutan dapat diilustrasikanseperti Gambar 6.1 di atas.
Jenis-jenis larutan
o Gas dalam gas - seluruh campuran gas
o Gas dalam cairan – oksigen dalam air
o Cairan dalam cairan – alkohol dalam air
o Padatan dalam cairan – gula dalam air
o Gas dalam padatan – hidrogen dalam paladium
o Cairan dalam padatan - Hg dalam perak
o Padatan dalam padatan - alloys
ELEKTROLIT (kls XI)
Berdasarkan kuat-lemahnya daya hantar listrik, larutan elektrolit dapatdikelompokkan menjadi dua, yaitu:
a. Larutan elektrolit kuat, yaitu larutan elektrolit yang mengalami ionisasi
sempurna. Indikator pengamatan: lampu menyala terang dan timbul gelembung gas pada elektrode.
Contoh: larutan H2SO4, larutan NaOH, dan larutan NaCl.
b. Larutan elektrolit lemah, yaitu larutan elektrolit yang mengalami sedikit
ionisasi (terion tidak sempurna). Indikator pengamatan: lampu tidak menyala atau menyala redup dan timbul gelembung gas pada elektrode.
Contoh: larutan CH3COOH dan larutan NH4OH.
Secara umum, perbedaan antara larutan elektrolit kuat dan elektrolit lemah
dapat disimpulkan sebagai berikut.
| No. | Elektrolit Kuat | Elektrolit Lemah |
| 1 | Dalam larutan terionisasi sempurna | Dalam larutan terionisasi sebagian |
| 2 | Jumlah ion dalam larutan sangat banyak | Jumlah ion dalam larutan sedikit |
| 3 | Menunjukkan daya hantar listrikyang kuat | Menunjukkan daya hantar listrik yang lemah |
| 4 | Derajat ionisasi mendekati 1(α=1) | Derajat ionisasi kurang dari 1 (α < 1) |
 Gambar 4.2(a) Larutan
Gambar 4.2(a) Larutan
Jawaban Latihan Ulangan
Kelas I (satu)
1. 1 mol adalah satuan bilangan kimia yang jumlah atom-atomnya atau molekul-molekulnya sebesar bilangan Avogadro dan massanya = Mr senyawa itu.
2. Tetapan Avogadro
L = 6.023 x 1023
L = 6.023 x 1023
3. Jumlah mol = Tetapan Avogadro X Jumlah partikel
4. = 3.01 x 1023 partikel = 0.5 mol
6.023 x 1023 partikel/mol
5. = 1.5 mol X 6.02 x 1023 partikel/mol = 9.03 x 1023
6. He(2) = 2, Ne(10) = 2,8, Ar(18) = 2,8,8, Kr(36) = 2,8,18,8, Ru(44)= 2,8,18,16
7. a. Natrium dioksida, b.Natrium Phospat, c. Dikloro tetraoksida
8. a. Periode ke 3 Golongan 2A, b. Periode ke 4 Golongan 4A, c.Periode ke 7 Golongan 2A
9. a.PCl5, b. Na2CO3, c. KNO3
10. = (1x2) + (32X1)+(16X4) = 2+32+64 = 98
Kelas II (dua)
1. Atom C Primer = atom C yang mengiikat 1 atom C lainnya, Atom C Sekunder = Atom C yang mengiikat 2 atom C lainnya, Atom C Tersier =atom C yang mengikat 3 atom C lainnya, dan Atom C kuarterner = atom C yang mengikat 4 atom C lainnya.
2. Hidrokarbon Jenuh = berikatan atom karbonnya tunggal, Hidrokarbon tak Jenuh = Ikanatan atom karbonnya rangkap.
3. gas, bensoll(afture), bensin(premium), kerosin (minyak tanah), solar, pelumas, parafin(lilin) aspal (residu)
4. Kc = (C)c x (D)d / (A)a x (B)b
5. Pembuatan Amonia untuk pembuatan pupuk anorganik seperti Urea, Pembuatan berbagai bahan plastik
6. Untuk mempercepat Laju Reaksi dapat digunakan katalisator
7. 1. Faktor Konsentrasi, 2. Suhu, 3. Tekanan, 4. Volume, 5. Katalisator
8. Adalah peristiwa/proses kimia yang berhubungan dengan perubahan enthalphi serta suhu yang menyertai perubahan tersebut.
9. Endoterm=terjadi peyerapan suhu dari lingkungan ke sistem contohnya pada alat pendingin, Eksoterm=terjadi pelepasan suhu dari sistem ke lingkungan contohnya pada preistiwa pembakaran.
10. Entalphi H = H akhir - H awal
Sentrifugasi pada Pemisahan Campuran (Kls XII Smt Genap)
Ditulis oleh Zulfikar pada 02-01-2011
Campuran heterogen terdiri dari senyawa-senyawa dengan berat jenis berdekatan sulit dipisahkan. Membiarkan senyawa tersebut terendapkan karena adanya grafitasi berjalan sangat lambat. Beberapa campuran senyawa yang memiliki sifat seperti ini adalah koloid, seperti emulsi.
Salah satu teknik yang dapat dipergunakan untuk memisahkan campuran ini adalah teknik sentrifugasi, yaitu metode yang digunakan dalam untuk mempercepat proses pengendapan dengan memberikan gaya sentrifugasi pada partikel-partikelnya.
Pemisahan sentrifugal menggunakan prinsip dimana objek diputar secara horizontal pada jarak tertentu. Apabila objek berotasi di dalam tabung atau silinder yang berisi campuran cairan dan partikel, maka campuran tersebut dapat bergerak menuju pusat rotasi, namun hal tersebut tidak terjadi karena adanya gaya yang berlawanan yang menuju kearah dinding luar silinder atau tabung, gaya tersebut adalah gaya sentrifugasi. Gaya inilah yang menyebabkan partikel-partikel menuju dinding tanbung dan terakumulasi membentuk endapan (Gambar 15.6).
Gambar 15.6. Pengendapan dengan teknik sentrifugasi
Mari kita perhatikan proses pembuatan minyak kelapa, dimana teknik pemisahan sentrifugasi cukup berperan. Buah kelapa dihancurkan, dan diperas sehingga didapat bagian santan. Didalam santan terdapat campuran minyak dengan air. Dengan melakukan sentrifugasi dengan kecepatan antara 3000-3500 rpm, maka terjadi pemisahan dan terdapat dua bagian yaitu fraksi kaya minyak (krim) dan fraksi miskin minyak (skim). Selanjutnya krim diasamkan, kemudian diberi perlakuan sentrifugasi sekali lagi untuk memisahkan minyak dari bagian bukan minyak.
Dalam pengolahan minyak kelapa, sering juga dilakukan modifikasi khususnya dalam pemisahan krim untuk mendapatkan bagian minyak. Modifikasi tersebut dilakukan dengan cara pemanasan krim, dan akan dihasilkan padatan dan minyak, selanjutnya dengan penyaringan kita dapatkan minyak kelapa yang bersih dan jernih.
Hukum Kesetimbangan (kelas 2 semester genap)
Ditulis oleh Redaksi chem-is-try.org pada 20-04-2009
Hukum Guldberg dan Wange:
Dalam keadaan kesetimbangan pada suhu tetap, maka hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan hasil kali konsentrasi pereaksi yang sisa dimana masing-masing konsentrasi itu dipangkatkan dengan koefisien reaksinya adalah tetap.
Pernyataan tersebut juga dikenal sebagai hukum kesetimbangan.
Untuk reaksi kesetimbangan: a A + b B ↔ c C + d D maka:
Untuk reaksi kesetimbangan: a A + b B ↔ c C + d D maka:
Kc = (C)c x (D)d / (A)a x (B)b
Kc adalah konstanta kesetimbangan yang harganya tetap selama suhu tetap.
BEBERAPA HAL YANG HARUS DIPERHATIKAN
Jika zat-zat terdapat dalam kesetimbangan berbentuk padat dan gas yang dimasukkan dalam, persamaan kesetimbangan hanya zat-zat yang berbentuk gas saja sebab konsentrasi zat padat adalah tetap den nilainya telah terhitung dalam harga Kc itu.Contoh: C(s) + CO2(g) ↔ 2CO(g)Kc = (CO)2 / (CO2)Jika kesetimbangan antara zat padat dan larutan yang dimasukkan dalam perhitungan Kc hanya konsentrasi zat-zat yang larutsaja.Contoh: Zn(s) + Cu2+(aq) ↔ Zn2+(aq) + Cu(s)
Kc = (Zn2+) / (CO2+)Untuk kesetimbangan antara zat-zat dalam larutan jika pelarutnya tergolong salah satu reaktan atau hasil reaksinya maka konsentrasi dari pelarut itu tidak dimasukkan dalam perhitungan Kc.Contoh: CH3COO-(aq) + H2O(l) ↔ CH3COOH(aq) + OH-(aq)
Kc = (CH3COOH) x (OH-) / (CH3COO-)
Contoh soal:
1. Satu mol AB direaksikan dengan satu mol CD menurut persamaan reaksi:
AB(g) + CD(g) ↔ AD(g) + BC(g)
Setelah kesetimbangan tercapai ternyata 3/4 mol senyawa CD berubah menjadi AD dan BC. Kalau volume ruangan 1 liter, tentukan tetapan kesetimbangan untuk reaksi ini !
Jawab:
Perhatikan reaksi kesetimbangan di atas jika ternyata CD berubah (bereaksi) sebanyak 3/4 mol maka AB yang bereaksi juga 3/4 mol (karena koefsiennya sama).
Dalam keadaan kesetimbangan:
Dalam keadaan kesetimbangan:
(AD) = (BC) = 3/4 mol/l
(AB) sisa = (CD) sisa = 1 – 3/4 = 1/4 n mol/l
(AB) sisa = (CD) sisa = 1 – 3/4 = 1/4 n mol/l
Kc = [(AD) x (BC)]/[(AB) x (CD)] = [(3/4) x (3/4)]/[(1/4) x (1/4)] = 9
2. Jika tetapan kesetimbangan untuk reaksi:
A(g) + 2B(g) ↔ 4C(g)
sama dengan 0.25, maka berapakah besarnya tetapan kesetimbangan bagi reaksi:
2C(g) ↔ 1/2A(g) + B(g)
2C(g) ↔ 1/2A(g) + B(g)
Jawab:
- Untuk reaksi pertama: K1 = (C)4/[(A) x (B)2] = 0.25
- Untuk reaksi kedua : K2 = [(A)1/2 x (B)]/(C)2
- Hubungan antara K1 dan K2 dapat dinyatakan sebagai:
K1 = 1 / (K2)2 ↔ K2 = 2
- Untuk reaksi kedua : K2 = [(A)1/2 x (B)]/(C)2
- Hubungan antara K1 dan K2 dapat dinyatakan sebagai:
K1 = 1 / (K2)2 ↔ K2 = 2
Konsep Mol (Kelas 1 semester genap)
Ditulis oleh Redaksi chem-is-try.org pada 03-04-2009
1 mol adalah satuan bilangan kimia yang jumlah atom-atomnya atau molekul-molekulnya sebesar bilangan Avogadro dan massanya = Mr senyawa itu.
Jika bilangan Avogadro = L maka :
L = 6.023 x 1023 |
1 mol atom = L buah atom, massanya = Ar atom tersebut.
1 mol molekul = L buah molekul massanya = Mr molekul tersehut.
1 mol molekul = L buah molekul massanya = Mr molekul tersehut.
Massa 1 mol zat disebut sebagai massa molar zat
Contoh:
Berapa molekul yang terdapat dalam 20 gram NaOH ?
Jawab:
Mr NaOH = 23 + 16 + 1 = 40
mol NaOH = massa / Mr = 20 / 40 = 0.5 mol
Banyaknya molekul NaOH = 0.5 L = 0.5 x 6.023 x 1023 = 3.01 x 1023 molekul.
Kekhasan Atom Karbon (kelas 3 semester ganjil)
Ditulis oleh Ratna dkk pada 28-12-2009
Atom karbon (C) dengan nomor atom 6 mempunyai susunan elektron K = 2, L = 4. C mempunyai 4 elektron valensi dan dapat mernbentuk empat ikatan kovalen serta dapat digambarkan dengan rumus Lewis. Sebagai contoh, dapat dilihat molekul CH4 (metana) yang memiliki diagram yang cukup sederhana dibawah ini.
Selain itu kemampuan diatas, atom karbon juga dapat membentuk ikatan dengan atom karbon lain untuk membentuk rantai karbon yang terbuka, terbuka bercabang dan tertutup. Contoh rantai karbon dapat digambarkan dengan rumus struktur berikut :
Dapatlah sekarang dimengerti bahwa jumlah senyawa karbon demikian banyaknya walaupun jumlah jenis unsur pembentuknya sedikit.
Kini kita dapat mulai membuat klasifikasi hidrokarbon, yang merupakan senyawa yang hanya tersusun oleh karbon dan hidrogen. Senyawa-senyawa karbon lainnya dapat dipandang sebagai turunan dari hidrokarbon ini. Hidrokarbon dapat dibagi menjadi dua kelompok utama : hidrokarbon alifatik dan hidrokarbon aromatik. Termasuk di kelompok pertama adalah senyawa yang berantai lurus, berantai cabang dan rantai melingkar. Kelompok kedua, hidrokarbon aromatik, biasanya mengandung cincin atom karbon yang sangat stabil. Berdasarkan kelipatan ikatan karbon-karbonnya, hidrokarbon alifatik masih dapat dibedakan lagi menjadi dua sub-kelompok, yakni hidrokarbon jenuh yang mengandung ikatan tunggal karbon-karbon, serta hidrokarbon tak jenuh yang mengandung paling sedikit satu ikatan rangkap dua, atau ikatan rangkap tiga.
Karena senyawa hidro karbon terdiri atas karbon dan hidrogen, maka salah satu bagian dari ilmu kimia yang membahas segala sesuatu tentang senyawa hidrokarbon disebut kimia karbon. Dulu ilmu kimia karbon disebut kimia organik, karena senyawa-senyawanya dianggap hanya dapat diperoleh dari tubuh makhluk hidup dan tidak dapat disintesis dalam pabrik.
Pada tahun 1928, Friedrich Wohler berhasil mensintesis urea (suatu senyawa yang terdapat dalam air seni) dari senyawa anorganik yaitu amonium sianat – dengan jalan memanaskannya.
Reaksi pemanasan amonium sianat oleh Wohler
Setelah keberhasilan Wohler diketahui, banyaklah sarjana lain yang mencoba membuat senyawa karbon dari senyawa anorganik. Lambat laun teori tentang arti hidup hilang dan orang hanya menggunakan kimia organik sebagai nama saja tanpa disesuaikan dengan arti yang sesungguhnya. Sejak saat itu banyak senyawa karbon berhasil disintesis dan hingga sekarang lebih dari 2 juta senyawa karbon dikenal orang dan terus bertambah setiap harinya. Apa sebabnya jumlah senyawa karbon sedemikian banyak bila dibandingkan dengan jumlah senyawa anorganik yang hanya sekitar seratus ribuan?
Selain perbedaan jumlah yang sangat mencolok yang menyebabkan kimia karbon dibicarakan secara tersendiri, karena memang terdapat perbedaan yang sangat besar antara senyawa karbon dan senyawa anorganik seperti yang dituliskan pada tabel berikut.
Hidrokarbon adalah sejenis senyawa yang banyak terdapat dialam sebagai minyak bumi. Indonesia banyak menghasilkan senyawa ini dalam bentuk minyak bumi yang mempunyai nilai ekonomi tinggi.
Senyawa hidrokarbon terdiri dari :
- Alkana (CnH2n+2)
- Alkena (CnH2n)
- Alkuna (CnH2n-2)
Larutan Elektrolit dan Non-Elektrolit (kelas 2 smt ganjil)
Ditulis oleh Utiya Azizah pada 24-02-2010
Berdasarkan sifat daya hantar listriknya, larutan dibagi menjadi dua yaitu larutan elektrolit dan larutan non elektrolit. Sifat elektrolit dan non elektrolit didasarkan pada keberadaan ion dalam larutan yang akan mengalirkan arus listrik. Jika dalam larutan terdapat ion, larutan tersebut bersifat elektrolit. Jika dalam larutan tersebut tidak terdapat ion larutan tersebut bersifat non elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Hantaran listrik melalui larutan dapat dtunjukkan dengan alat uji elektrolit seperti pada Gambar 7. Jika larutan menghantarkan arus listrik, maka lampu dalam rangkaian tersebut akan menyala dan timbul gas atau endapan pada salah satu atau kedua elektroda.
Contoh lain adalah, bila NaCl dilarutan dalam air akan terurai menjadi ion positif dan ion negatif. Ion positif yang dihasilkan dinamakan kation dan ion negatif yang dihasilkan dinamakan anion. Larutan NaCl adalah contoh larutan elektrolit. Perhatikan reaksi berikut.
Bila gula dilarutkan dalam air, molekul-molekul gula tersebut tidak terurai menjadi ion tetapi hanya berubah wujud dari padat menjadi larutan. Larutan gula adalah contoh dari larutan non elektrolit. Perhatikan reaksi berikut:
Dalam kehidupan sehari-hari kita banyak menemukan contoh larutan elektrolit maupun non elektrolit. Contoh larutan elektrolit: larutan garam dapur, larutan cuka makan, larutan asam sulfat, larutan tawas, air sungai, air laut. Contoh larutan non elektrolit adalah larutan gula, larutan urea, larutan alkohol, larutan glukosa.
Persamaan Reaksi
Ditulis oleh Redaksi chem-is-try.org pada 04-04-2009
PERSAMAAN REAKSI MEMPUNYAI SIFAT
- Jenis unsur-unsur sebelum dan sesudah reaksi selalu sama
- Jumlah masing-masing atom sebelum dan sesudah reaksi selalu sama
- Perbandingan koefisien reaksi menyatakan perbandingan mol (khusus yang berwujud gas perbandingan koefisien juga menyatakan perbandingan volume asalkan suhu den tekanannya sama)
Contoh: Tentukanlah koefisien reaksi dari
HNO3 (aq) + H2S (g) → NO (g) + S (s) + H2O (l)
Cara yang termudah untuk menentukan koefisien reaksinya adalah dengan memisalkan koefisiennya masing-masing a, b, c, d dan e sehingga:
a HNO3 + b H2S → c NO + d S + e H2O
Berdasarkan reaksi di atas maka
atom N : a = c (sebelum dan sesudah reaksi)
atom O : 3a = c + e → 3a = a + e → e = 2a
atom H : a + 2b = 2e = 2(2a) = 4a → 2b = 3a → b = 3/2 a
atom S : b = d = 3/2 a
atom O : 3a = c + e → 3a = a + e → e = 2a
atom H : a + 2b = 2e = 2(2a) = 4a → 2b = 3a → b = 3/2 a
atom S : b = d = 3/2 a
Maka agar terselesaikan kita ambil sembarang harga misalnya a = 2 berarti: b = d = 3, dan e = 4 sehingga persamaan reaksinya :
2 HNO3 + 3 H2S → 2 NO + 3 S + 4 H2O
Penyetaraan Reaksi Kimia
Ditulis oleh Zulfikar pada 06-04-2010
Dasar untuk penyetaraan reaksi kimia adalah hukum kekalan massa yang diajukan oleh Lavoiser, dan dinyatakan”Dalam sebuah reaksi, massa zat-zat sebelum bereaksi sama dengan massa zat sesudah bereaksi”. Hal ini menunjukkan kepada kita bahwa tidak ada massa yang hilang selama berlangsung reaksi.
Dalam persamaan reaksi kimia terdapat dua daerah, daerah dimana zat sebelum bereaksi di sebelah kiri tanda panah dan daerah dimana zat telah bereaksi di sebelah kanan tanda panah. Untuk lebih mudahnya perhatikan bagan reaksi 2.14.
Bagan. 2.14. Bagan reaksi yang menyatakan zat sebelum dan sesudah reaksi
Di kedua daerah tersebut, kita akan mendapatkan informasi bahwa zat sebelum dan sesudah reaksi adalah sama, kesamaan ini dapat ditunjukkan dengan kesetaraan jumlah atom, atau jumlah massa. Contoh di bawah ini dapat menjelaskan informasi apa saja yang kita dapat dari sebuah persamaan reaksi
C + O2 → CO2
Persamaan reaksi ini benar jika jumlah atom karbon di sebelah kiri tanda panah (sebelum bereaksi) sama dengan jumlah atom sebelah kanan tanda panah (sesudah reaksi). Demikian pula dengan atom Oksigen sebelum dan sesudah reaksi adalah sama. Lihat bagan reaksi 2.15.
Dari gambar tampak bahwa jumlah atom C di sebelah kiri dan kanan adalah sama, sebanyak 1 buah. Demikian pula untuk atom O jumlahnya sama yaitu 2 buah. Dengan demikian persamaan reaksi ini sudah benar.
Informasi lain adalah jumlah massa Karbon dan Oksigen sebelum dan sesudah reaksi adalah sama, misalnya terdapat 12 gram karbon dan 32 gram oksigen sebelum bereaksi, berdasarkan kesetaraan jumlah atom yang sama, maka secara otomatis jumlah zat yang terjadi juga memiliki komposisi massa yang sama. Senyawa CO2, mengandung 12 gram C dan 32 gram O, perhatikan persamaan reaksi pada bagan reaksi 2.16.
Bagan 2.16. Bagan reaksi yang menggambarkan kesetaraan massa dari atom C dan O di sebelah kiri dan kanan tanda panah
Umumnya persamaan reaksi dituliskan belum sempurna, dimana jumlah atom sesudah dan sebelum bereaksi belum sama seperti :
N2 + H2 → NH3
Jumlah atom N sebelah kiri tanda panah sebanyak 1 buah, di sebelah kanan tanda panah 1 buah, sehingga yang di sebelah kanan tanda panah dikalikan 2. Akibat perkalian ini jumlah atom H di sebelah kan menjadi 6 buah, sedangkan di sebelah kiri terdapat 2 buah. Untuk menyetarakan jumlah atom H, maka atom H sebelah kiri dikalikan 3. Lihat bagan reaksi 2.17.
Bagan 2.17. Bagan reaksi yang menggambarkan tahap penyetaraan persamaan reaksi pembentukan NH3
Angka pengali yang dipergunakan untuk menyetarakanan reaksi, selanjutnya dimasukan ke dalam persamaan reaksi.
Mengukur jari-jari atom
Tidak seperti halnya bola, sebuah atom tidak memiliki jari-jari yang tetap. Jari-jari atom hanya bisa didapat dengan mengukur setengah dari jarak antara dua buah atom yang berapitan.
Gambar pada bagian kiri menunjukkan atom yang berikatan. Kedua atom ini saling menarik satu sama lain sehingga jari-jarinya lebih pendek dibandingkan jika mereka hanya bersentuhan. Hal ini kita dapatkan pada atom-atom logam di mana mereka membentuk struktur logam atau atom-atomnya secara kovalen berikatan satu sama lain. Tipe dari jari-jari atom seperti ini disebut jari-jari (radius) logam atau jari-jari kovalen, tergantung dari ikatannya.
Gambar pada bagian kanan menunjukkan keadaan di mana kedua atom hanya bersentuhan. Daya tarik antar keduanya sangat sedikit. Tipe dari jari-jari atom seperti ini dinamakan jari-jari (radius) van der Waals di mana terjadi daya tarik yang lemah di antara kedua atom tersebut.
Kecenderungan jari-jari atom pada tabel periodik
Pola kecenderungan jari-jari atom tergantung dari jenis jari-jari atom mana yang ingin kita ukur – tapi pada prinsipnya pola seluruhnya sama.
Diagram-diagram di bawah ini menunjukkan jari-jari logam untuk elemen-elemen logam, jari-jari kovalen untuk elemen-elemen yang membentuk ikatan kovalen dan jari-jari van der Waals untuk elemen-elemen yang tidak membentuk ikatan (misalnya unsur gas mulia).
Kecenderungan jari-jari atom pada periode 2 dan 3
Kita dapat segera memperkirakan bahwa jari-jari atom pada golongan yang sama akan semakin besar jika letak atom itu pada tabel periodik semakin di bawah. Alasannya cukup kuat – karena kulit elektron semakin bertambah.
Kecenderungan jari-jari atom menyusur satu periode
Kita perlu mengabaikan jari-jari gas mulia pada setiap periode. Karena neon dan argon tidak membentuk ikatan, kita hanya dapat mengukur jari-jari van der Waals – di mana ikatannya sangatlah lemah. Seluruh atom-atom lainnya jari-jari atom diukur berdasarkan jarak yang lebih kecil dikarenakan oleh kuatnya ikatan yang terbentuk. Kita tidak dapat membandingkan “suatu sifat yang sama” jika kita mengikutsertakan gas mulia.
Kecuali gas mulia, atom akan semakin kecil menyusur satu periode
Dari litium ke flor, elektron seluruhnya berada pada level dua, yang dihalangi oleh elektron pada 1s2. Peningkatan jumlah proton pada nukleus seiring dengan menyusurnya periode akan menarik elektron-elektron lebih kuat. Kecenderungan pada energi ionisasi yang naik turun tidak kita temui pada radius atom.
Pada periode dari Natrium ke Klor, kita juga akan menemukan kecenderungan yang sama. Besar atom dikontrol oleh elektron-elektron pada tingkat ke 3 yang tertarik semakin dekat ke nukleus seiring dengan meningkatnya jumlah proton.
Kecenderugan pada elemen-elemen transisi
Walaupun pada awal dari elemen-elemen transisi, jari-jari atom sedikit mengecil, besar jari-jari atom hampir seluruhnya sama.
Dalam hal ini, besar dari jari-jari atom ditentukan oleh elektron-elektron 4s. Penarikan karena naiknya jumlah proton pada nukleus berkurang karena adanya penghalang tambahan yaitu bertambahnya elektron-elektron pada orbital 3d.
Memang hal ini agak sedikit membingungkan. Kita telah mempelajari bahwa orbital-orbital 4s memiliki tingkat energi lebih tinggi daripada 3d – di mana kebalikannya elektron akan menempati 4s sebelum 3d. Artinya, elektron-elektron 4s dapat kita simpulkan berada pada luar atom dan menentukan besarnya atom. Hal ini juga berarti orbital 3d berada lebih dekat dengan nukleus daripada 4s dan berperan sebagai penghalang.
Ion-ion tidak memiliki besar yang sama dengan atom asalnya. Bandingkan besarnya ion natrium dan klor dengan atom natrium dan klor.
Ion Positif
Ion positif lebih kecil dibandingkan dengan atom asalnya. Konfigurasi elektron natrium adalah 2,8,1 ; sementara Na+ adalah 2,8. Kita kehilangan salah satu kulit elektron dan 10 elektron yang tersisa ditarik oleh 11 proton pada nukleus.
Ion Negatif
Ion negatif lebih besar dibandingkan dengan atom asalnya. Konfigurasi elektron klor adalah 2,8,7 ; sementara Cl- adalah 2,8,8. Walaupun elektron-elektron masih berada pada tingkat 3, penolakan tambahan terjadi karena bertambahnya elektron yang menyebabkan atom semakin membesar. Ion klor hanya memiliki 17 proton, tetapi mereka sekarang memiliki 18 elektron.
Perkembangan Teori Pengelompokan UNSUR
Kata Kunci: Hukum oktaf Newlands, Periode dan Golongan, Sistem Periodik Mendeleev, Sistem Periodik Moseley, Triad Dobereiner
Ditulis oleh Ratna dkk pada 14-04-2009
Pada awalnya, unsur hanya digolongkan menjadi logam dan nonlogam. Dua puluh unsur yang dikenal pada masa itu mempunyai sifat yang berbeda satu dengan yang lainnya. Setelah John Dalton mengemukakan teori atom maka terdapat perkembangan yang cukup berarti dalam pengelompokan unsur-unsur. Penelitian Dalton tentang atom menjelaskan bahwa setiap unsur mempunyai atom-atom dengan sifat tertentu yang berbeda dari atom unsur lain. Hal yang membedakan diantara unsur adalah massanya.
Pada awalnya massa atom individu belum bisa ditentukan karena atom mempunyai massa yang amat kecil sehingga digunakan massa atom relatif yaitu perbandingan massa antar-atom. Berzelius pada tahun 1814 dan P. Dulong dan A. Petit pada tahun 1819 melakukan penentuan massa atom relatif berdasarkan kalor jenis unsur. Massa atom relatif termasuk sifat khas atom karena setiap unsur mempunyai massa atom relatif tertentu yang berbeda dari unsur lainnya. Penelitian selanjutnya melibatkan Dobereiner, Newlands, mendeleev dan Lothar Meyer yang mengelompokkan unsur berdasarkan massa atom relatif.
Triad Dobereiner
Johann Wolfgang Dobereiner pada tahun 1829 menjelaskan hasil penelitiannya yang menemukan kenyataan bahwa massa atom relatif stronsium berdekatan dengan massa rata-rata dua unsur lain yang mirip dengan stronsium yaitu kalsium dan barium. Hasil penelitiannya juga menunjukkan bahwa beberapa unsur yang lain menunjukkan kecenderungan yang sama. Berdasarkan hasil penelitiannya, Dobereiner selanjutnya mengelompokkan unsur-unsur dalam kelompok-kelompok tiga unsur yang lebih dikenal sebagai triad. Triad yang ditunjukkan oleh Dobereiner tidak begitu banyak sehingga berpengaruh terhadap penggunaannya.
Massa Atom Relatif Unsur Triad Dobereiner
Triad Dobereiner
Hukum oktaf Newlands
Hukum oktaf ditemukan oleh A. R. Newlands pada tahun 1864. Newlands mengelompok-kan unsur berdasarkan kenaikan massa atom relatif unsur. Kemiripan sifat ditunjukkan oleh unsur yang berseliih satu oktaf yakni unsur ke
Hukum oktaf Newlands ternyata hanya berlaku untuk unsur-unsur dengan massa atom relatif sampai 20 (kalsium). Kemiripan sifat terlalu dipaksakan apabila pengelompokan dilanjutkan.
Sistem Periodik Mendeleev
Dmitri Ivanovich Mendeleev pada tahun 1869 melakukan pengamatan terhadap 63 unsur yang sudah dikenal dan mendapatkan hasil bahwa sifat unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akan berulang secara periodik apabila unsurunsur disusun berdasarkan kenaikan massa atom relatifnya. Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut periode. Sistem periodik yang disusun Mendeleev dapat dilihat pada tabel berikut:
Mendeleev sengaja mengosong-kan beberapa tempat untuk menetapkan kemiripan sifat dalam golongan. Beberapa kotak juga sengaja dikosongkan karena Mendeleev yakin masih ada unsur yang belum dikenal karena belum ditemukan. Salah satu unsur baru yang sesuai dengan ramalan Mendeleev adalah germanium yang sebelumnya diberi nama ekasilikon oleh Mendeleev.
Sistem Periodik Moseley
Perkembangan terbaru mengenai atom menjelaskan bahwa atom dapat terbagi menjadi partikel dasar atau partikel subatom. Atom selanjutnya diketahui tersusun oleh proton, elektron dan netron. Jumlah proton merupakan sifat khas unsur. Setiap unsur mempunyai jumlah proton tertentu yang berbeda dari unsur lain. Jumlah proton suatu unsur dinyatakan sebagai nomor atom.
Henry G. Moseley yang merupakan penemu cara menentukan nomor atom pada tahun 1914 kembali menemukan bahwa sifat-sifat unsur merupakan fungsi periodik nomor atomnya. Pengelompokan yang disusun oleh Mendeleev merupakan susunan yang berdasarkan kenaikan nomor atomnya. Penyusunan telurium dan iodin yang tidak sesuai dengan kenaikan massa atom relatifnya ternyata sesuai dengan kenaikan nomor atomnya.
Henry G. Moseley
Periode dan Golongan
Sistem periodik modern tersusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Lajur horisontal yang disebut periode, tersusun berdasarkan kenaikan nomor atom sedangkan lajur vertikal yang disebut golongan tersusun berdasarkan kemiripan sifat. Unsur golongan A disebut golongan utama sedangkan golongan B disebut golongan transisi. Golongan dapat dieri tanda nomor 1 sampai 18 berurutan dari kiri ke kanan. Berdasarkan penomoran ini, golongan transisi mempunyai nomor 3 sampai 12.
Sistem periodik modern tersusun atas 7 periode dan 18 golongan yang terbagi menjadi 8 golongan utama atau golongan A dan 8 golongan transisi atau golongan B.
Contoh soal :
Tentukan periode dan golongan unsur X, Y dan Z apabila diketahui konfigurasi elektronnya adalah
X = 2, 3
Y = 2, 8, 4
Z = 2, 8, 7
Jawab:
Unsur Periode Golongan
X 2 IIIA
Y 3 IVA
Z 3 VIIA
POLIMER
Ditulis oleh Ratna dkk pada 19-01-2010
Definisi
Polimer atau kadang-kadang disebut sebagai makromolekul, adalah molekul besar yang dibangun oleh pengulangan kesatuan kimia yang kecil dan sederhana. Kesatuan-kesatuan berulang itu setara dengan monomer, yaitu bahan dasar pembuat polimer (tabel 1). Akibatnya molekul-molekul polimer umumnya mempunyai massa molekul yang sangat besar. Sebagai contoh, polimer poli (feniletena) mempunyai harga rata-rata massa molekul mendekati 300.000. Hal ini yang menyebabkan polimer tinggi memperlihatkan sifat sangat berbeda dari polimer bermassa molekul rendah, sekalipun susunan kedua jenis polimer itu sama.
Klasifikasi
Senyawa-senyawa polimer didapatkan dengan dua cara, yaitu yang berasal dari alam (polimer alam) dan di polimer yang sengaja dibuat oleh manusia (polimer sintetis).
Polimer yang sudah ada dialam (polimer alam), seperti :
1. Amilum dalam beras, jagung dan kentang
2. Selulosa dalam kayu
3. Protein terdapat dalam daging
4. Karet alam diperoleh dari getah atau lateks pohon karet
Karet alam merupakan polimer dari senyawa hidrokarbon, yaitu 2-metil-1,3-butadiena (isoprena). Ada juga polimer yang dibuat dari bahan baku kimia disebut polimer sintetis seperti polyetena, polipropilena, poly vynil chlorida (PVC), dan nylon. Kebanyakan polimer ini sebagai plastik yang digunakan untuk berbagai keperluan baik untuk rumah tangga, industri, atau mainan anak-anak.
Reaksi Polimerisasi
Reaksi polimerisasi adalah reaksi penggabungan molekul-molekul kecil (monomer) yang membentuk molekul yang besar. Ada dua jenis reaksi polimerisasi, yaitu : polimerisasi adisi danpolimerisasi kondensasi.
Polimerisasi Adisi
Polimerisasi ini terjadi pada monomer yang mempunyai ikatan tak jenuh (ikatan rangkap dengan melakukan reaksi dengan cara membuka ikatan rangkap (reaksi adisi) dan menghasilkan senyawa polimer dengan ikatan jenuh.
Mekanisme reaksi :
Contoh :
Pembentukan Polietena (sintesis)
Polietena merupakan plastik yang dibuat secara sintesis dari monomer etena (C2H4) menurut reaksi adisi berikut :
Pembentukan Poli-isoprena (alami)
Poli-isoprena merupakan karet alam dengan monomer 2-metil-1,3 butadiena. Reaksi yang terjadi dengan membuka salah satu ikatan rangkap dan ikatan rangkap yang lainnya berpindah
menurut reaksi adisi :
Polimer Berdasarkan Reaksi Pembentukannya
Ditulis oleh Utiya Azizah pada 18-04-2009
Apakah Anda pernah berpikir mengenai banyaknya perbedaan dari jenis-jenis polimer yang dibentuk? Polimerisasi merupakan suatu jenis reaksi kimia dimana monomer-monomer bereaksi untuk membentuk rantai yang besar.
Dua jenis utama dari reaksi polimerisasi adalah polimerisasi adisidan polimerisasi kondensasi. Jenis reaksi yang monomernya mengalami perubahan reaksi tergantung pada strukturnya. Suatu polimer adisi memiliki atom yang sama seperti monomer dalam unit ulangnya, sedangkan polimer kondensasi mengandung atom-atom yang lebih sedikit karena terbentuknya produk sampingan selama berlangsungnya proses polimerisasi.
Polimer Adisi
Reaksi pembentukan teflon dari monomer-monomernya tetrafluoroetilen, disebut reaksi adisi. Perhatikan Gambar 7 yang menunjukkan bahwa monomer etilena mengandung ikatan rangkap dua, sedangkan di dalam polietilena tidak terdapat ikatan rangkap dua.


Gambar 7. Monomer etilena mengalami reaksi adisi membentuk polietilena yang digunakan sebagai tas plastik, pembungkus makanan, dan botol. Pasangan elektron ekstra dari ikatan rangkap dua pada tiap monomer etilena digunakan untuk membentuk suatu ikatan baru menjadi monomer yang lain.
Menurut jenis reaksi adisi ini, monomer-monomer yang mengandung ikatan rangkap dua saling bergabung, satu monomer masuk ke monomer yang lain, membentuk rantai panjang. Produk yang dihasilkan dari reaksi polimerisasi adisi mengandung semua atom dari monomer awal. Berdasarkan Gambar 7, yang dimaksud polimerisasi adisi adalah polimer yang terbentuk dari reaksi polimerisasi disertai dengan pemutusan ikatan rangkap diikuti oleh adisi dari monomermonomernya yang membentuk ikatan tunggal. Dalam reaksi ini tidak disertai terbentuknya molekul-molekul kecil seperti H2O atau NH3.
Contoh lain dari polimer adisi diilustrasikan pada Gambar 8. Suatu film plastik yang tipis terbuat dari monomer etilen dan permen karet dapat dibentuk dari monomer vinil asetat.


Gambar 8. Polietilen dan polivinil asetat adalah contoh polimer yang dibuat melalui polimerisasi adisi.
Dalam reaksi polimerisasi adisi, umumnya melibatkan reaksi rantai. Mekanisme polimerisasi adisi dapat dibagi menjadi tiga tahap yaitu:

Sebagai contoh mekanisme polimerisasi adisi dari pembentukan polietilena
a) Inisiasi, untuk tahap pertama ini dimulai dari penguraian inisiator dan adisi molekul monomer pada salah satu radikal bebas yang terbentuk. Bila kita nyatakan radikal bebas yang terbentuk dari inisiator sebagai R’, dan molekul monomer dinyatakan dengan CH2 = CH2, maka tahap inisiasi dapat digambarkan sebagai berikut:

b) Propagasi, dalam tahap ini terjadi reaksi adisi molekul monomer pada radikal monomer yang terbentuk dalam tahap inisiasi


c) Terminasi, dapat terjadi melalui reaksi antara radikal polimer yang sedang tumbuh dengan radikal mula-mula yang terbentuk dari inisiator (R’) CH2 – CH2 + R � CH2 – CH2- R atau antara radikal polimer yang sedang tumbuh dengan radikal polimer lainnya, sehingga akan membentuk polimer dengan berat molekul tinggi R-(CH2)n-CH2° + °CH2-(CH2)n-R’ � R-(CH2)n-CH2CH2-(CH2)n-R’ Beberapa contoh polimer yang terbentuk dari polimerisasi adisi dan reaksinya antara lain.
- Polivinil klorida
n CH2 = CHCl → [ - CH2 - CHCl - CH2 - CHCl - ]n Vinil klorida polivinil klorida
- Poliakrilonitril
n CH2 = CHCN → [ - CH2 - CHCN - ]n
- Polistirena

Polimer Kondensasi
Polimer kondensasi terjadi dari reaksi antara gugus fungsi pada monomer yang sama atau monomer yang berbeda. Dalam polimerisasi kondensasi kadang-kadang disertai dengan terbentuknya molekul kecil seperti H2O, NH3, atau HCl.
Di dalam jenis reaksi polimerisasi yang kedua ini, monomer-monomer bereaksi secara adisi untuk membentuk rantai. Namun demikian, setiap ikatan baru yang dibentuk akan bersamaan dengan dihasilkannya suatu molekul kecil – biasanya air – dari atom-atom monomer. Pada reaksi semacam ini, tiap monomer harus mempunyai dua gugus fungsional sehingga dapat menambahkan pada tiap ujung ke unit lainnya dari rantai tersebut. Jenis reaksi polimerisasi ini disebut reaksi kondensasi.
Dalam polimerisasi kondensasi, suatu atom hidrogen dari satu ujung monomer bergabung dengan gugus-OH dari ujung monomer yang lainnya untuk membentuk air. Reaksi kondensasi yang digunakan untuk membuat satu jenis nilon ditunjukkan pada Gambar 9 dan Gambar 10.
Gambar 9. Kondensasi terhadap dua monomer yang berbeda yaitu 1,6 – diaminoheksana dan asam adipat yang umum digunakan untuk membuat jenis nylon. Nylon diberi nama menurut jumlah atom karbon pada setiap unit monomer. Dalam gambar ini, ada enam atom karbon di setiap monomer, maka jenis nylon ini disebut nylon 66.

Contoh lain dari reaksi polimerisasi kondensasi adalah bakelit yang bersifat keras, dan dracon, yang digunakan sebagai serat pakaian dan karpet, pendukung pada tape – audio dan tape – video, dan kantong plastik.
Monomer yang dapat mengalami reaksi polimerisasi secara kondensasi adalah monomer-monomer yang mempunyai gugus fungsi, seperti gugus -OH; -COOH; dan NH3.